2020年10月15日,新葡萄8883官网AMG李力课题组和武汉大学生命科学学院吴旻课题组在国际著名期刊Hepatology杂志上发表了题为Deficiency of histone methyltransferase SETD2 in liver leads to abnormal lipid metabolism and hepatocarcinoma的研究工作,证实了SETD2缺失促进肝癌(HCC)发生,并阐明了SETD2在肝癌中调节胆固醇稳态和c-Jun/AP1信号转导的作用机制。
肝癌是世界常见恶性肿瘤,在亚洲尤其是我国发病率极高。肝脏在体内胆固醇代谢平衡中发挥极重要作用。肝癌的发生发展是一个非常复杂的生物学过程,受到机体的系统性调控。肝癌使肝脏代谢功能受到极大的损伤,导致包括胆固醇代谢在内的许多代谢过程出现病理性变化。然而,胆固醇代谢变化的调控机理在肝癌发生发展中的作用还不清楚。
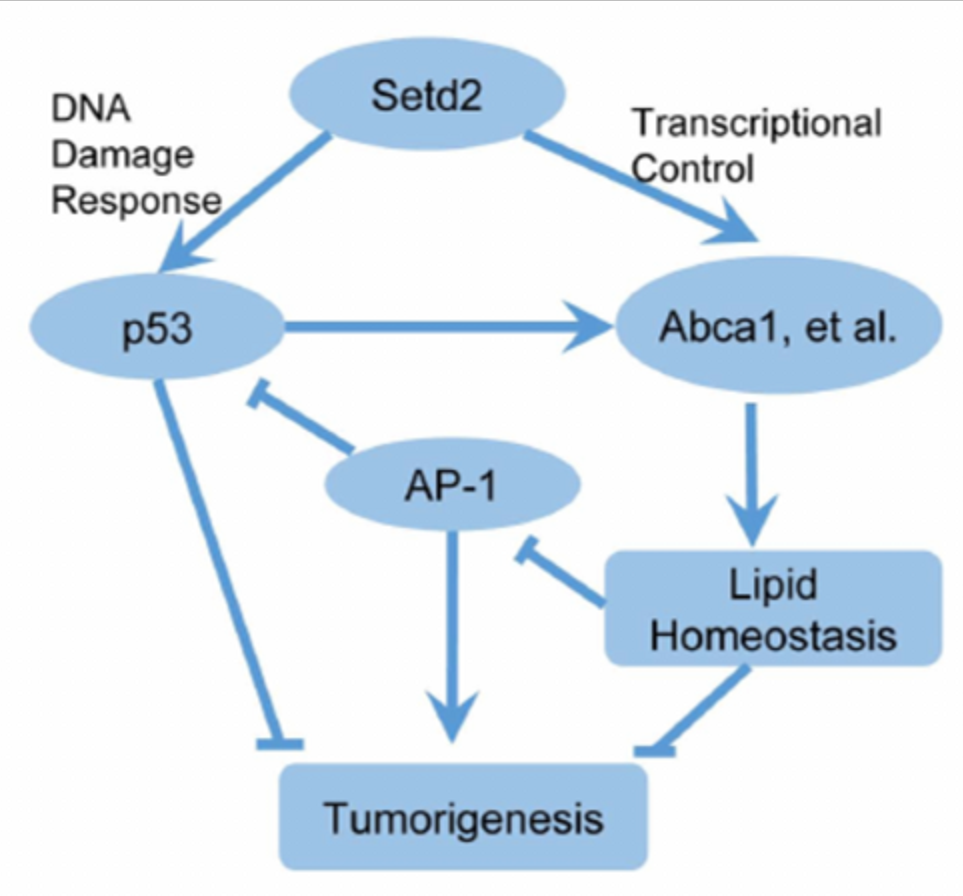
组蛋白甲基转移酶SETD2(SET domain-containing protein 2)催化的H3K36me3是从酵母到哺乳动物最保守的表观遗传标记之一。SETD2在多种癌症中经常发生突变。李力副研究员在2014年建立了Setd2条件性基因敲除小鼠模型并在生殖、发育和癌症等领域展开广泛的功能研究(Zuo et al, J Bio Chem, 2018;Wang et al, PLoS Biol, 2018;Xu et al, Nat Genet, 2019;Ji et al,Nat Commun,2019;Niu et al,Gut,2020)。合作组由此展开进一步研究,利用肝脏特异性Setd2缺失模型,发现Setd2缺乏足以引发自发性肝癌。同时,Setd2缺失显著增加了DEN诱导的HCC模型的肿瘤数量和肿瘤大小。

进一步研究表明,Setd2不仅通过调节DNA损伤反应抑制HCC,而且通过调节肝脏脂质代谢来抑制HCC。Setd2缺乏可下调H3K36me3胆固醇外流基因的富集和表达,引起脂质积聚。高脂饮食促进Setd2基因缺陷小鼠脂质积累,促进肝癌的发生。ChIP-Seq分析显示,Setd2缺失可诱导肝脏c-Jun/AP-1激活,这是由脂质累积引起的。c-Jun作为HCC的癌基因,通过抑制Setd2缺陷细胞中的p53发挥作用。本研究首次揭示了Setd2在肝癌中的作用,揭示了其调节胆固醇稳态和c-Jun/AP1信号转导的机制,深入了对其病理机制的认识,为肝癌靶向治疗提供了新的理论依据。
武汉大学李雪晶为该论文的第一作者;吴旻教授和李力副研究员为该论文的共同通讯作者。该研究课题得到了国家科技部,国家自然科学基金委和上海市科委的资助。
原文链接: https://doi.org/10.1002/hep.31594
